Numa manhã de abril de 2023, Marcela Maus, investigadora de cancro no Mass General Research Institute, em Boston, recebeu uma chamada do seu colega Bryan Choi.
«Ele ligou-me e disse: “Meu Deus, meu Deus, meu Deus!” E eu respondi: “O que está a acontecer?”», conta a Dra. Maus. O Dr. Choi, neurocirurgião com o temperamento tranquilo de um surfista, não era dado a explosões emocionais. A Dra. Maus correu para o consultório dele. No dia anterior, ambos tinham tratado o seu primeiro paciente num ensaio clínico para um cancro cerebral agressivo chamado glioblastoma, infundindo glóbulos brancos geneticamente modificados diretamente no líquido que envolve o cérebro.
Ficaram a noite toda acordados com a preocupação, em particular depois de o paciente, um homem de 74 anos, ter ficado com febre.
O Dr. Choi solicitou uma ressonância magnética. Quando a Dra. Marcela Maus chegou ao consultório do Dr. Choi, as imagens da ressonância magnética estavam a ser carregadas no ecrã. Observaram maravilhados. O tumor do paciente, que alguns dias antes aparecia na imagem como uma mancha brilhante do tamanho de um morango, tinha desaparecido quase por completo.
«O meu primeiro instinto foi pensar que havia algo de errado com o aparelho de ressonância magnética», confessa o Dr. Choi. Mas as imagens seguintes pareciam ainda melhores. Várias semanas depois, outro paciente, um engenheiro civil do norte do estado de Nova Iorque chamado Tom Fraser, e, para seu espanto, o processo repetiu-se. A infusão, a febre e a rápida regressão do tumor.
«Era quase como um relógio», diz a Dra. Maus. Depois de o terceiro paciente ter tido uma resposta semelhante, ela interrompeu o ensaio e registou os resultados.
O glioblastoma é o tipo mais comum de cancro cerebral maligno nos adultos. Pode ocorrer em qualquer idade e é quase sempre fatal. Os pacientes são frequentemente diagnosticados nas urgências depois de o tumor causar uma resposta somática, como convulsões, perda súbita da fala ou incapacidade de controlar os membros. O tempo médio entre o diagnóstico e a morte é de pouco mais de um ano.
O primeiro passo no tratamento da doença não mudou em décadas: «ressecção máxima segura», uma cirurgia para remover o máximo possível do tumor, preservando a função neurológica.
Como o glioblastoma é tão hábil a infiltrar-se no cérebro, o cirurgião quase sempre deixa sobras de tumor, que rapidamente começa a crescer novamente. Alguns pacientes respondem à radiação ou ao medicamento quimioterápico temozolomida, mas mesmo esses adicionam meses, e não anos, ao tempo médio de sobrevivência.
Roger Stupp, especialista em glioblastoma, diz que a doença mostrou ser «um cemitério de ideias». Décadas de investigação não levaram a lugar algum.
Nos últimos vinte anos, no entanto, um campo antes fora de moda, chamado imunoterapia, superou todas as expectativas na oncologia. Parte de uma premissa simples: o sistema imunológico humano é muito bom a atacar aquilo que considera uma doença. Se pudesse ser usado contra o cancro, poderia eliminar um tumor de forma mais completa do que o bisturi de um cirurgião e de forma mais duradoura do que o veneno da quimioterapia.
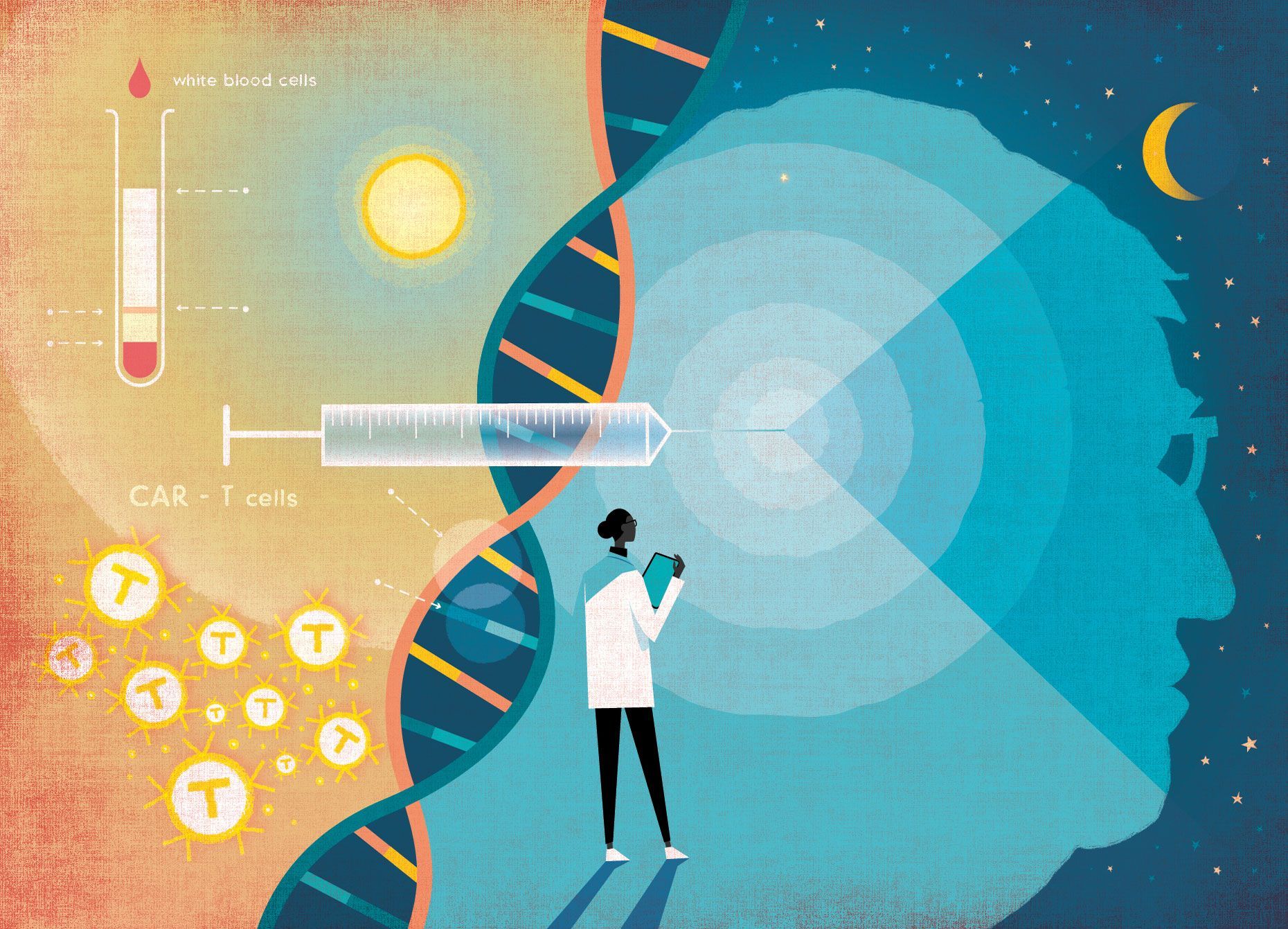
A Dra. Maus e o Dr. Choi pensaram que tinham encontrado uma maneira de fazer exatamente isso usando o assassino multifuncional do sistema imunológico: a célula T, que o corpo envia para neutralizar agentes patogénicos de todos os tipos, incluindo bactérias, vírus e parasitas, mas não (normalmente) o cancro.
Ao extrair células T do sangue de um paciente, manipular o ADN das células em laboratório e reintroduzi-las no local do tumor, fizeram com que o corpo reagisse ao cancro como reagiria a um vírus e o destruísse. Foi o culminar de anos de investigação. Tom Fraser lembra que, no dia em que recebeu a infusão, a sala estava lotada de médicos, enfermeiros e cientistas. Havia a sensação, diz, de que estava a ser feita história. «Senti uma pequena picada quando inseriram a agulha», lembra, «mas foi um processo muito rápido». Vinte e quatro dias depois saiu do hospital, fraco e exausto, mas com o tumor em remissão quase total.
«Houve uma revolução na compreensão do cancro e nas ferramentas para o combater», afirma o oncologista investigador Daniel Haber, diretor do Mass General Cancer Center. A imunoterapia, combinada com a compreensão cada vez melhor da genética das células cancerosas, produziu avanços para formas anteriormente intratáveis da doença, em particular tumores líquidos como a leucemia e a linfoma, e cancros de pele, como o melanoma. Sentenças de morte foram comutadas. Casos sem esperança foram curados.
Até recentemente, a maior exceção a esta série de boas notícias eram os tumores sólidos, como o cancro do pâncreas e o glioblastoma. Portanto, Tom Fraser está certo. Se estes resultados iniciais se mantiverem, isso fará história. Se pudermos tratar o glioblastoma – talvez o caso mais difícil num campo composto por casos difíceis –, não haverá um tipo de cancro que pareça estar fora de alcance.
Depois de o Dr. Choi e a Dra. Maus terem publicado os seus resultados no New England Journal of Medicine, receberam mensagens de oncologistas de todo o mundo. «Eles estão desesperados e dizem: “Queremos oferecer alguma coisa, porque não há nada disponível”», afirma o Dr. Choi.
Os pacientes com glioblastoma são frequentemente encaminhados para cirurgia poucos dias após o diagnóstico. A urgência resulta tanto da agressividade da doença como da natureza única do próprio cérebro. Preso dentro do crânio, não tem para onde ir quando um tumor começa a crescer. À medida que o tecido normal é empurrado para o lado, os efeitos neurológicos podem multiplicar-se rapidamente. O cancro noutras partes do corpo pode ser debilitante, mas é improvável que tire repentinamente a capacidade de falar, mover-se ou pensar.
A Dra. Maus e a sua equipa começaram a inscrever novos participantes no ensaio em maio de 2024. Centenas de pessoas com glioblastoma escreveram ou ligaram para o Mass General devido ao estudo, mas a Dra. Maus tinha espaço para apenas mais dezoito. «É de partir o coração», diz a Dra. Marcela Maus sobre ter de recusar pessoas.
Kevin McKay, de Annapolis, no Maryland, foi diagnosticado com um tumor cerebral em 2016. Naquele verão, ele e esposa, Katie McKay, estavam a caminho de Myrtle Beach para passar férias com os dois filhos, de 3 e 5 anos. Kevin começou a ter convulsões e a gemer. As crianças estavam a ver desenhos animados no banco de trás, «e pensaram que ele estava a brincar com elas, como se fosse um monstro, e eu também o pensei», explica Katie. «Agarrei o braço dele e percebi que tinha os olhos revirados.»
No hospital em Myrtle Beach, os médicos viram duas lesões no seu cérebro. Kevin fez a primeira cirurgia na Johns Hopkins e começou a fazer radiação e quimioterapia.
Katie e Kevin começaram a namorar na faculdade. Conheceram-se na Universidade de Maryland e casaram em 2010. «Ele era muito adorável», diz Katie. Gostava de pregar pequenas partidas à família. Colocava pimento habanero na bebida de Katie quando ela não estava a ver ou acordava a sogra com um soprador de folhas. Tinha 32 anos quando foi diagnosticado. Teve de desistir do trabalho como engenheiro. Perdeu a capacidade de sentir o lado esquerdo. Em pouco tempo, deixou de conseguir falar. Kevin morreu em julho de 2018, dois anos depois da primeira convulsão.
Quando a Dra. Maus iniciou o doutoramento em imunologia há pouco mais de vinte e cinco anos, a ideia de que um dia isso poderia fazer desaparecer tumores cerebrais como o de Kevin era ridícula. «Disseram-me que era suicídio profissional», confessa a Dra. Maus. «As pessoas tentavam há cem anos fazer com que o sistema imunológico reconhecesse o cancro, e era um beco sem saída.»
Ela sabia que, embora o cancro tenha fintado por muito tempo os esforços para o eliminar, tem uma vulnerabilidade. As células cancerosas precisam de ser pelo menos um pouco diferentes das outras células do corpo, ou não seriam cancro. Se fosse possível treinar as células T do sistema imunológico para reconhecer essa diferença, seria o fim da doença.
Os esforços para atingir esse objetivo já transformaram a oncologia. Os investigadores desenvolveram medicamentos que se ligam seletivamente às proteínas das células cancerosas, inativando-as (terapias direcionadas); descobriram maneiras de atacar tumores modulando a resposta imunológica do corpo (inibidores de pontos de controlo imunológicos); e tornaram-se eficazes a cultivar glóbulos brancos fora do corpo e a reintroduzi-los para dominar um tumor.
Algumas destas abordagens, embora poderosas, eram um pouco como inundar a casa para se livrar de ratos. E se pudéssemos contratar um exterminador em vez disso? Os imunologistas concentraram-se na célula T, aprendendo a manipular o seu código genético para a levar a procurar proteínas específicas na superfície das células cancerosas. Esta célula T modificada tem um nome especial: célula CAR-T. (CAR significa «recetor de antigénio quimérico»). O recetor é o que liga uma célula T a uma proteína na superfície de uma célula. Antigénio é outro nome para essa proteína. E a quimera, neste caso, é o híbrido entre o recetor normal da célula T e os seus componentes geneticamente modificados.
Há uma década, quando a Dra. Maus estava na Universidade da Pensilvânia, o seu mentor, o imunologista Carl June, desenvolveu uma terapia eficaz com células CAR-T para a leucemia. Quase da noite para o dia, as células CAR-T tornaram-se a tecnologia mais empolgante no tratamento do cancro. Hoje, mais de 34 mil pacientes com leucemia receberam algum tipo de terapia com células CAR-T.
A grande questão na oncologia atual é se esta abordagem também pode ser usada para tumores sólidos. A Dra. Maus foi uma das dezenas de especialistas em imunoterapia que começaram a procurar um cancro adequado para um novo ensaio com células CAR-T. «Não sou especialista em nenhuma doença neste momento», diz, «mas penso muito em como fazer com que as células T façam aquilo que queremos. A célula T é o meu martelo e ando à procura de pregos.»
Ela sabia que o glioblastoma tinha um alvo promissor para o martelo das células T: um antígeno chamado variante III do recetor do fator de crescimento epidérmico (EGFRvIII), que não se encontra no tecido cerebral saudável. Num ensaio clínico que iniciou antes de se mudar para o Mass General, ela e um neurocirurgião da Universidade da Pensilvânia, o Dr. Donald O'Rourke, administraram aos pacientes injeções de células T modificadas para atacar o EGFRvIII.
Algumas células CAR-T chegaram ao cérebro dos pacientes, mas não pareciam ter qualquer efeito no tumor. Quando a Dra. Maus montou o seu laboratório no Mass General em 2015, tinha duas ideias para melhorar o tratamento, «uma grande e outra média».
A média era infundir as células T diretamente no fluido que envolve o cérebro, o que, esperava, permitiria que fossem mais a chegar ao tumor. A grande ideia destinava-se a resolver um problema separado.
O glioblastoma, como a maioria dos tumores sólidos, é heterogéneo. Diferentes partes do tumor têm diferentes proteínas nas superfícies das suas células, o que torna impossível eliminá-las atacando apenas o EGFRvIII. A nova célula CAR-T da Dra. Marcela Maus foi projetada para segregar uma molécula chamada acoplador de células T biespecífico, que agia como fita-cola de dupla face, facilitando a ligação das células T a uma segunda proteína, chamada EGFR de tipo selvagem. A abordagem, diz a Dra. Maus, foi «tão aperfeiçoada como eu poderia imaginar». A Dra. Maus e o Dr. Haber estavam a jantar quando ela lhe mostrou as imagens do primeiro paciente. «O mundo parou», diz ele. As possibilidades ficaram imediatamente claras. «Se realmente resulta no glioblastoma», refere, «isso abre todo o leque de tumores sólidos?»
A Dra. Maus é rápida a apontar os limites do que esta primeira fase do ensaio provou. Tom Fraser, que teve a resposta mais duradoura, viu recentemente sinais de que o seu cancro está a começar a crescer novamente.
«Sinto que isto foi um duplo ou um triplo», afirma a Dra. Maus. «Não é um home run.»
A avaliação do Dr. June é mais otimista. Ele compara a experiência da Dra. Maus ao seu célebre trabalho com a leucemia. Levou apenas cinco anos para passar dos primeiros resultados promissores à aprovação da FDA. Hoje, milhares de pacientes foram efetivamente curados. «Acho que até 2029 teremos a aprovação da FDA das células CAR-T para glioblastoma», refere.
Os investigadores do cancro são fluentes na linguagem do fracasso. O século passado, dividido aproximadamente ao meio pela declaração de guerra ao cancro de Richard Nixon em 1971, foi marcado por frustrações e contratempos, abordagens que deviam ter resultado, mas não resultaram. Os oncologistas pensavam que estavam a tratar uma única doença, mas agora sabem que não existem dois cancros iguais. Na verdade, o mesmo cancro pode ser muito diferente de pessoa para pessoa.
«O cancro», diz o Dr. Haber, «é tão complicado quanto a medicina».
Apesar de todas as promessas da imunoterapia, existem grandes obstáculos. O primeiro deles é o custo. No laboratório da Dra. Maus, cada dispositivo e cada pessoa representam espirais estreitamente enroladas de tempo e dinheiro. Há máquinas de PCR, cabines de biossegurança, leitores ELISA, autoclaves, congeladores, contadores de células, incubadoras e centrífugas – uma proliferação de máquinas brancas e quadradas que fazem o espaço parecer um escritório com um número invulgar de minifrigoríficos.
O tratamento pode custar entre 500 mil a um milhão de dólares americanos. Mesmo que as empresas farmacêuticas não tentem lucrar, o processo é trabalhoso. As células T precisam de ser removidas do sangue do paciente, alteradas geneticamente e, em seguida, reintroduzidas.
O complicado processo de produção de células CAR-T também limita o número de pessoas que podem ser tratadas. Para uma terapia emergente como a CAR-T para glioblastoma, as restrições são ainda maiores. Por exemplo, como querem garantir que qualquer resultado positivo possa ser atribuído apenas ao regime de células CAR-T, os critérios de exclusão descartam uma pessoa que tenha sido tratada com «qualquer terapia genética prévia ou terapia celular modificada geneticamente».
-------------------------------------------------------------------------------------------------------
Milhares de pessoas foram efetivamente curadas.
-------------------------------------------------------------------------------------------------------
Nenhum dos oncologistas com quem conversei achava que a imunoterapia substituiria por completo as abordagens comprovadas. Alguns tipos de cancro ainda serão mais bem tratados por cirurgia, outros por radiação ou quimioterapia. A terapia com células CAR-T pode ser reservada para os cancros mais resistentes. No entanto, à medida que mais tratamentos com células CAR-T obtêm a aprovação da FDA, o custo e a eficiência podem melhorar.
«Estamos no início da curva da descoberta», diz o Dr. Haber, «mas a ciência baseia-se em si mesma e, às vezes, coisas que são incrivelmente complicadas, caras e perigosas abrem as portas para coisas que se tornam muito mais democráticas, acessíveis e normais».
A Dra. Maus e o Dr. Choi já aperfeiçoaram o protocolo para o seu ensaio clínico com glioblastoma. Agora, os pacientes irão passar por um curto período de quimioterapia antes da infusão para limitar o número de células CAR-T mortas ou inativadas pelo sistema imunológico inato, permitindo que mais permaneçam ativas no local do tumor durante mais tempo. A Dra. Maus diz que, quando o Mass General a contratou, não estavam à procura de um especialista em CAR-T, mas de um especialista em células T. A diferença era significativa.
A célula CAR-T, por mais complicada que seja, é uma expressão de um conhecimento muito mais profundo. Talvez seja assim que, em última análise, reduziremos os custos. Quanto melhor compreendermos o sistema imunitário, mais fácil será encontrar formas de o fazer funcionar como queremos.
No primeiro dia do verão de 2024 fui visitar Tom Fraser, participante n.º 2 do ensaio, na sua casa. Tinha sido avisado de que o cancro lhe dificultava a fala e todas as minhas comunicações telefónicas até então foram com a esposa, Debbie Fraser. Foi uma agradável surpresa ser recebido à porta por um homem alto e robusto, com cabelos grisalhos.
«Bem-vindo», cumprimentou, apertando-me a mão. «Sou Tom Fraser.» Conduziu-me à sua cozinha arrumada, onde nos sentámos e conversámos durante quase duas horas. O sol lá fora estava quase insuportavelmente forte.
Antes de se reformar, Tom dirigia uma empresa de engenharia forense. Na sequência de uma catástrofe, ele era chamado para determinar as respetivas causas. Quando um armazém da Bethlehem Steel, perto de Buffalo, ardeu em 2016, lançando uma nuvem de fumo tão grande que 300 famílias e várias escolas tiveram de ser evacuadas, Tom determinou que a culpa tinha sido de um sistema de iluminação instalado incorretamente que tinha projetado faíscas em materiais inflamáveis que estavam por baixo.
Ele adota a mesma abordagem metódica para falar do curso da sua doença, consultando uma linha do tempo que traçou num bloco de notas. «Anotei algumas datas aqui só para me lembrar», confessa.
Em agosto de 2021, os Fraser estavam hospedados na sua casa de campo – uma pequena casa branca situada numa rocha no rio São Lourenço · quando Tom percebeu que algo estava errado.
«Levantei-me de manhã», explica, «e não conseguia ler».
Demorou um mês para marcar uma ressonância magnética. Depois de fazer o exame, o diagnóstico não tardou. Nunca tinha ouvido falar em glioblastoma, mas o médico foi direto: sem tratamento, poderia morrer em seis meses. Ele e a esposa contaram a notícia à família – quatro filhas e oito netos – por Zoom.
Uma das filhas de Tom trabalha como assistente médica no Mass General e encorajou-o a viajar até lá para remover o tumor. O cirurgião, o Dr. Brian Nahed, demorou quase cinco horas a concluir a operação. Tom mostra-me a cicatriz, em forma de ferradura, no lado esquerdo da cabeça. «Não faz mal desde que consiga pentear o cabelo por cima», diz.
Após a cirurgia, começou a fazer radiação e quimioterapia, e depois foi submetido a um tratamento com o Optune Gio, um dispositivo vestível que usa campos elétricos para tentar interromper a divisão celular. O Dr. Nahed foi franco. «Ele disse nos: “Isso vai resultar até deixar de resultar”», diz Debbie. «“É assim que acontece. Este cancro heterogéneo descobre formas de se adaptar. É isso que o torna tão agressivo e tão difícil de tratar”.»
Mesmo assim, quando o cancro reapareceu passados vinte meses, os Fraser sentiram-se apanhados de surpresa. Foi o Dr. Nahed quem sugeriu que Tom se inscrevesse no ensaio clínico no Mass General.
No dia da infusão, no verão de 2023, trinta pessoas aglomeraram-se na sala para assistir. Apesar de todo o tempo, dinheiro e inovação investidos para chegar a esse momento, a cena era estranhamente humilde. Uma sala de hospital normal, Tom sentado na cama enquanto um médico empurrava o êmbolo de uma seringa.
O mês seguinte foi difícil. Embora as tomografias mostrassem que o tumor estava a diminuir, correspondendo aos resultados dramáticos do primeiro paciente, os médicos tinham relutância em dar muita importância a isso. Nas semanas seguintes, Tom teve uma série de complicações: fibrilação atrial, infeções misteriosas, febre alta.
O Dr. Choi tentou tranquilizá-los, dizendo que os efeitos eram um sinal de que o tratamento estava a resultar.
«Quando saí», afirma Tom, «mal conseguia andar». Debbie mostra-me uma foto daquele dia. Nela, Tom parecia fraco e infeliz «Não era ele», afirma. «Deixa-me ver isso», pede Tom, e Debbie vira a foto para ele.
«Oh, esse não sou eu.» Quando chegaram a Nova Iorque, os netos receberam-nos com um cartaz que onde se lia «Bem-vindos a casa!» com um arco-íris desenhado à mão na parte inferior.
Naquele outono, Tom sentiu-se forte o suficiente para voltar à casa de campo. Queria ajudar a lavar a casa com uma máquina de alta pressão, mas Debbie não deixou. «Sabíamos que a situação estava estável, mas não sabíamos os resultados mais minuciosos», diz Debbie. Tudo mudou quando a Dra. Maus e a sua equipa publicaram o artigo no New England Journal of Medicine.
Se a terapia com células CAR-T para glioblastoma se tornar padrão – se a Dra. Maus e outros puderem reproduzir e melhorar os resultados que ela obteve com Tom Fraser –, o seu nome ficará para sempre ligado ao nascimento deste tratamento. «Não devia dizer isto, mas estou um pouco orgulhoso de mim», diz Tom.
A esperança pode ser uma injeção de adrenalina ou uma infusão intravenosa constante, mas é sempre um remédio forte. Os dias intensos das primeiras tomografias já ficaram para trás. Os Fraser estabeleceram um ritmo, algo parecido com o que tinham antes do diagnóstico. Tom também mudou a forma como fala sobre a sua doença. Durante anos, ele falou sobre vencer o glioblastoma – encontrar uma cura para si. Agora, está mais propenso a referir-se aos pacientes que virão depois dele, que sem dúvida viverão mais tempo por causa do que aprendemos com a sua resposta à terapia com células CAR-T.
No entanto, ele pode ainda não ter terminado a sua luta. Depois de um exame em fevereiro de 2024 ter mostrado sinais de recorrência, novas imagens tiradas em junho de 2024 mostraram exatamente o oposto. O tumor parecia ter encolhido novamente. «Caramba, vou dançar», disse.
Agora, de acordo com Debbie, ele está em melhor forma do que há meses. Foi um efeito temporário ou um sinal de que as células T ainda estavam ativas? Só o saberemos daqui a alguns anos, e mesmo assim apenas por implicação, se um sinal suficientemente forte surgir de futuros ensaios com células CAR-T.
Enquanto isso, Tom falou-me de uma viagem que ele e Debbie estavam a planear: «Nunca visitei Chicago. Eu disse: “Isso é loucura. Quero ver esse lugar – por isso vamos lá.”» Naquela manhã, eles tinham ido à formatura do quinto ano do neto. Era um dia quente e ficaram sentados a suar no estacionamento. Já tinham passado quase três anos desde que lhe disseram que poderia ter seis meses de vida.